- Главная страница
- Медиатека
- Информационные статьи
- Проблемы визуализации единичных биомолекул методом АСМ: контроль как способ решения: поддержка компании «Хеликон»
Медиатека
Проблемы визуализации единичных биомолекул методом АСМ: контроль как способ решения
Статья Марии Ершовой, студентки магистерской программы «Структурная биология и биотехнология» МГУ имени М. В. Ломоносова и стипендиата Компании Хеликон.
Компания Хеликон всегда стремилась поддерживать отечественных учёных – как опытных специалистов, так и студентов, которые только делают первые шаги в науке. С этой целью мы учредили ежегодную стипендию «Хеликон» для молодых биологов со всей страны. Первыми стипендиатами стали студенты магистерской программы «Структурная биология и биотехнология», реализуемой на базе МГУ имени М.В. Ломоносова.
Предлагаем вам ознакомиться со статьёй Марии Ершовой, посвящённой визуализации единичных биомолекул методом атомно-силовой микроскопии. Мария рассказывает, на что исследователям стоит обращать внимание при планировании эксперимента, чтобы достичь достоверных результатов.
Атомно-силовая микроскопия (АСМ) открывает большие возможности при изучении биосистем на уровне единичных биомолекул. С помощью АСМ можно изучать такие характеристики единичных молекул, как морфология, жесткость, вязкость, гидрофобность, проводимость и поверхностный потенциал. 1 Биомолекулы могут быть адсорбированы на различных материалах, например, свежесколотых и модифицированных слюдяных подложках. Главным критерием отбора поверхности служит атомарная ровность. Так как единичные биомолекулы имеют нанометровые размеры, то возникает проблема верной идентификации целевых объектов. То есть, если исследователь использовал в своих экспериментах недостаточно чистые материалы и реактивы, на АСМ-изображении могут быть визуализированы объекты, не относящиеся к целевым. Помочь с решением данной проблемы может контроль качества используемых в работе материалов и реактивов.
Контроль качества производится на основе оценки «чистоты» поверхности после инкубации в исследуемых растворах или после стадии модификации подложек. Что значит «чистота»? Как её оценить? Чистота оценивается по количеству и характеристикам объектов — частиц, визуализируемых на атомарно ровной поверхности.
Подготовка образца к АСМ-анализу включает следующие этапы:
1. Проверка используемых подложек на всех стадиях модификаций.
2. Проверка используемых растворов (буферов, спирта, деионизованной воды и других.).
Особое внимание при проведении исследований с помощью АСМ уделяется подготовке подложки для эффективной адсорбции биомолекул, а именно её модификации. Модификации необходимы для придания поверхности определенных функциональных свойств. Например, нанесение монослоев аминопропилтриэтоксисилана (APTES) позволяет получить на поверхности большое количество аминогрупп, которые могут реагировать с функциональными группами биомолекул. Также можно использовать химические сшивающие агенты (кросс-линкеры) для ковалентной иммобилизации биомолекул на поверхности подложки. Таким образом, контроль качества также необходим на всех стадиях модификаций поверхности.
При проведении экспериментов исследователь использует различные растворы, например, буферы, спирты, деионизованную воду и другие. Объекты из используемых растворов могут неспецифически сорбироваться на поверхность, также возможно выпадение солей. Методика подготовки подложек для контроля качества используемых растворов может быть следующей (Рис. 1):
1. Свежесколотая слюда инкубируется в объеме анализируемого раствора в течение требуемого времени. В случае анализа буферных растворов и растворов кросс-линкеров после инкубации следует отмывка. В случае анализа этанола и воды отмывка не проводится.
2. После инкубации или отмывки подложки сушатся.
3. Далее следует АСМ-анализ поверхности подложек.
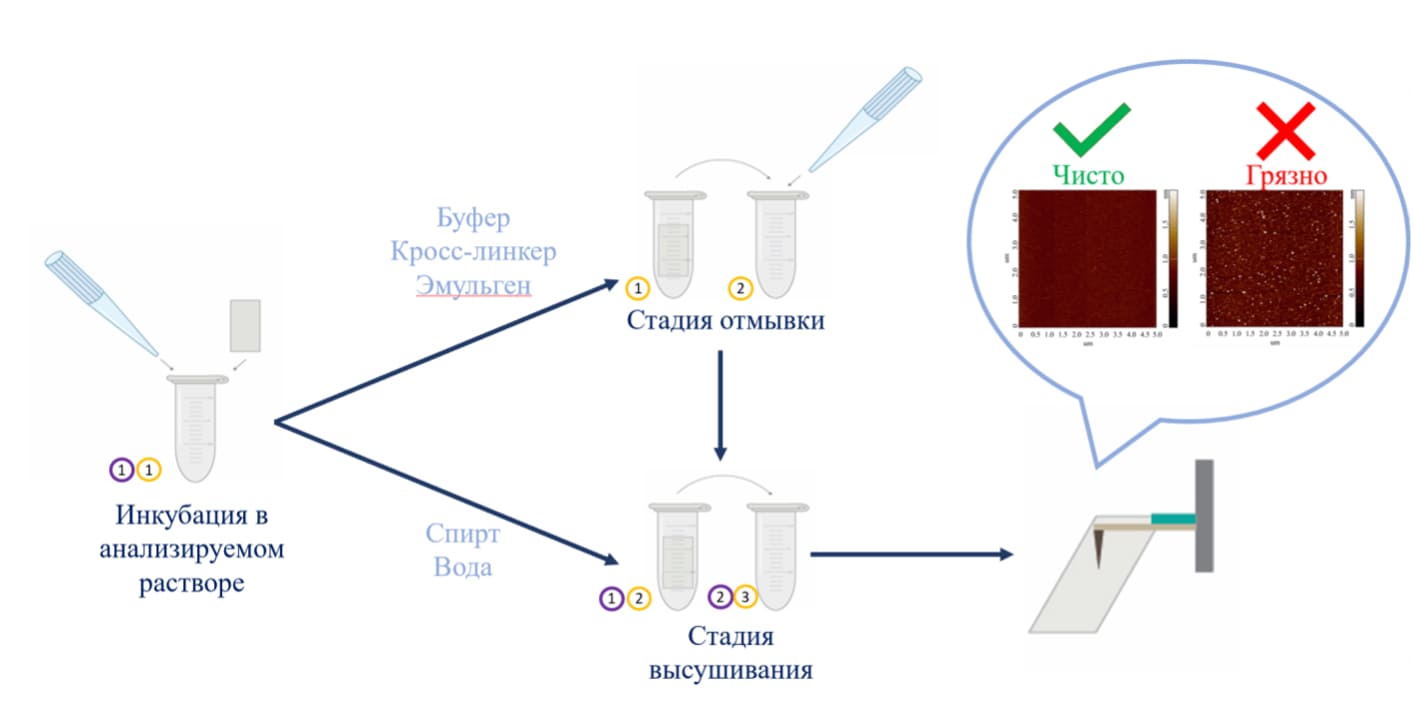
Рисунок 1. Схематическое изображение пробоподоготовки АСМ-чипа для анализа чистоты инкубационных и отмывочных растворов.
Контрольные АСМ-измерения проводятся при АСМ-сканировании поверхности слюды для учета объектов высотой более 1 нм. Сканирование осуществляется минимум в 5 участках всей поверхности подложки. Согласно научным данным, шумовым сигналом являются максимум 500 объектов на 400 мкм². 2 Следовательно, на каждом полученном изображении размером 5*5 мкм² должно присутствовать не более 30 неспецифических объектов. В случае, если визуализируется большее количество объектов с высотой более 1 нм, данный образец подложки считается не прошедшим контрольную проверку и в дальнейших опытах не используется, а растворы подвергаются дополнительной фильтрации. Примеры результатов АСМ-анализа поверхности модифицированных подложек в зависимости от стадии подготовки представлены на рисунке 2. Как видно из рисунка 2, на поверхности отсутствуют объекты высотой более 1 нм, следовательно, подложки прошли контроль качества и могут быть использованы в дальнейших исследованиях.
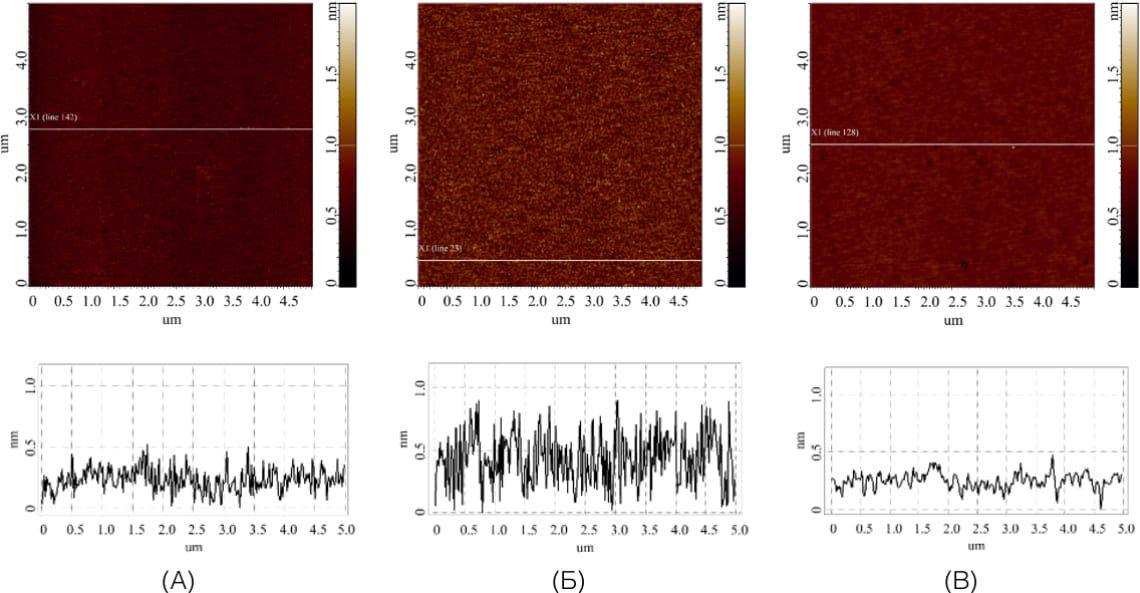
Рисунок 2. Типичные АСМ-изображения разных поверхностей, а также профили сечений, соответствующие белым линиям на АСМ-изображениях: (А) — свежесколотая слюдяная подложка; (Б) — аминосиланизированная слюдяная подложка; (В) — модифицированная кросс-линкером поверхность аминосиланизированной слюдяной подложки (Image Analysis Trunk).
Таким образом, успешность АСМ-исследования единичных биомолекул требует особой чистоты используемых в работе материалов и реактивов, а также отработки протоколов, включающих подбор оптимальных условий инкубации для качественной АСМ-визуализации. Кроме того, АСМ-исследование требует особой культуры работы — использования одноразовой посуды и одноразовых материалов (пробирки, наконечники, чашки Петри и др.). Исследователю необходимо уделить особое внимание защите образца от загрязнения: проводить работы в чистых помещениях и носить соответствующую одежду (халаты, перчатки, шапочки, маску).
Автор: Ершова Мария
Литература
1. Franz C. M., Puech P. H. Atomic force microscopy: a versatile tool for studying cell morphology, adhesion and mechanics // Cellular and Molecular Bioengineering. – 2008. – V. 1. – №. 4. – P. 289-300.
2. Иванов Ю. Д. и др. Химический необратимый фишинг низкокопийных белков // Биомедицинская химия. – 2014. – Т. 60. – №. 1. – С. 28-50.
АСМ-измерения были выполнены на приборах Titanium и NTEGRA Aura (NT-MDT, Зеленоград, Россия) на базе лаборатории нанобиотехнологии НИИ биомедицинской химии имени В.Н. Ореховича в рамках Программы фундаментальных научных исследований Российской Федерации на долгосрочный период (2021-2030 годы).




.jpg)